date:2024-02-23 14:14:46
熒光肌動蛋白染色,特別是使用phalloidin,通過顯微鏡深入了解細胞結構和過程的一種強大方法。這種方法可以對肌動蛋白絲進行特定的可視化,使熒光肌動蛋白染色成為科學家解答許多與細胞生物學相關問題(包括細胞骨架組織和動力學)的不可或缺的工具。
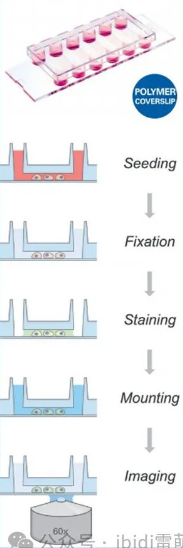
本實驗方案中,我們提出了一種使用µ- slide VI 0.4六通道載玻片培養和對粘附性人纖維肉瘤細胞系HT-1080肌動蛋白熒光染色的簡便方案。
請注意: 在開始肌動蛋白熒光染色之前必須檢查幾個重要的參數,如最佳細胞密度,理想的細胞培養器皿及底部/涂層。此外,陽性和陰性對照是驗證染色的必要條件。因此,我們強烈建議在實驗前進行充分的文獻研究。
1. 材料
1.1. 試劑和緩沖液
細胞培養
• HT-1080細胞(85111505, Sigma Aldrich)
• 細胞培養基: DMEM (D6546, Sigma Aldrich),含10%胎牛血清 (F1283, Sigma Aldrich)
• D-PBS (14190144, Gibco)
• Accutase (A1110501, Gibco)
熒光染色與成像
• D-PBS (14190144, Gibco)
• 福爾馬林,10%,當即可用 (HT5011, Sigma Aldrich)
• Triton-X-100 (A16046, Thermo Fisher Scientific)
• 滲透性緩沖液 (0.1% Triton-X-100 in D-PBS)
• 牛血清白蛋白 (BSA) (A1470-10G, Sigma Aldrich)
• 封閉緩沖液 (1% BSA in D-PBS)
• Phalloidin溶液:1µl Phalloidin- ifluor 488 Reagent (ab176753, Abcam)在1 ml封閉緩沖液中
• ibidi封片劑,含DAPI (50011, ibidi)
• ibidi浸漬油 (50101, ibidi)
1.2. 設備
• µ-Slide VI0.4 ibiTreat (80606, ibidi)
• µ-Slide支架 (80003, ibidi)
• 標準細胞培養設備(移液槍,超凈工作臺,細胞培養箱,培養瓶,細胞培養基,血細胞計等)
• 倒置熒光顯微鏡與適配的濾光片組

2. 方法
2.1. 細胞培養
在使用μ -Slide VI0.4之前,請閱讀使用說明書。在無菌條件下進行所有步驟。建議在細胞接種前一天將
µ-Slide VI0.4和細胞培養基放入培養箱中,以避免處理過程中形成氣泡。在開始實驗之前,在具有粘附細胞的標準底的細胞培養瓶(例如T75)中制備HT-1080細胞。理想情況下,在實驗當天,細胞應該是低融合和健康的。
在整個過程中迅速工作是至關重要的,以防止細胞干涸。
如未另行說明,所有給定的體積都是單通道的,所有培養步驟都是在室溫下進行的。
• 將10ml Accutase加入T75培養瓶中進行細胞分離;在培養箱(37°C,5%CO2)中培養5分鐘。
• 收集細胞懸液,離心,并將其稀釋在少量細胞培養基中進行計數。
• 計數細胞,并在細胞培養基中調整到最終濃度為3 × 105 cells/ml。
• 打開ibidi µ-Slide VI0.4,并將其放在µ-Slide支架或合適的表面上。
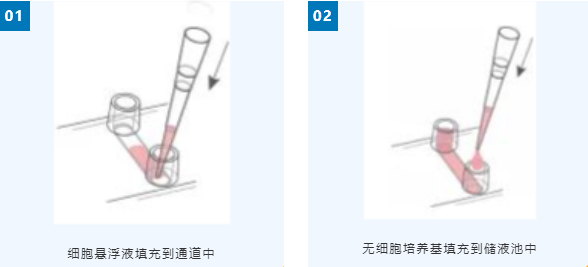
• 將30µl HT-1080細胞懸液移液填充到每個通道中。快速填充有助于避免截留氣泡。
• 通過傾斜µ-Slide通道載玻片并輕敲一側邊緣,清除通道中截留的氣泡。
• 用隨附的蓋子蓋上儲液池。
• 將µ-Slide通道載玻片與支架放入培養箱(37 °C, 5 % CO2),讓細胞附著 ( 1小時)。
• 在每個儲液池中加入60µl無細胞細胞培養基。避免截留氣泡。
• 將µ-Slide通道載玻片與支架放入培養箱(37 °C, 5 % CO2),并將細胞孵育過夜。
• 就延長細胞培養,建議每兩天連續更換一次培養基(詳見如下2.2)。
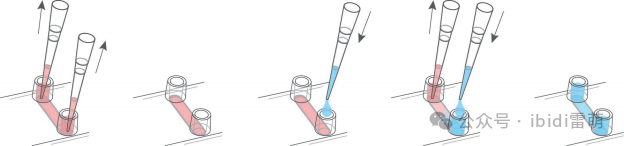
2.2. 連續更換培養基
• 小心地從儲液池中抽吸培養基。不要從通道中吸入任何液體。
• 輕輕地將120µl無細胞培養基導入一個儲液池中,使通道得以補充。
• 從對面的儲液池中抽吸舊的培養基。使用細胞培養抽吸裝置時要小心,因為這可能會吸走部分附著的細胞或細胞簇。
• 每個儲液池使用60µl無細胞培養基重新填充儲液池。
以最小容量為通道容量的三倍連續更換培養基
2.3. 固定, 透化和封閉
• 快速執行所有步驟,確保通道不會干涸。為實驗準備足夠的滲透緩沖液和封閉緩沖液。
• 通過連續的培養基交換用D-PBS代替細胞培養基進行洗滌。
• 抽吸大部分D-PBS。不要全部吸出。
• 用100µl福爾馬林(10%)固定細胞20分鐘。
• 連續換液,用200µl D-PBS洗滌細胞3次。
• 抽吸大部分D-PBS。不要全部吸出。
• 在100µl滲透緩沖液中孵育細胞5分鐘。
• 用200µl D-PBS連續換液清洗細胞。
• 抽吸大部分D-PBS。不要全部吸出。
• 用100µl封閉緩沖液封閉20分鐘。
• 用200µl D-PBS清洗細胞。
2.4. 染色
• 從儲液器和通道中吸出所有D-PBS。使用5毫升注射器填充空通道,以盡量減少引入氣泡的風險。
• 立即將30µl的phalloidin溶液加入通道中; 在暗處培養20分鐘。樣品應盡可能放在暗處保存。
• 連續交換培養基,用200µl D-PBS洗滌細胞2次。
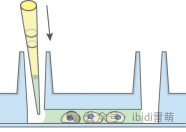
2.5. 封片
• 吸取所有D-PBS,立即加入ibidi含DAPI的封片劑進行核染色,直到通道被填滿。如果使用不同的封片劑,請注意它必須是非干燥的,以避免損壞µ-Slide。
• 在4°C暗處儲存,直到成像。
• 染色后的µ-Slide可保存4周。理想情況下,應立即進行成像,因為較長的存儲時間會降低圖像質量。
2.6. 成像
• 在熒光顯微鏡下用適當的濾光片組觀察細胞,必要時用ibidi浸漬油。
• 可選,疊加圖像以創建合并圖像。
3. 結果
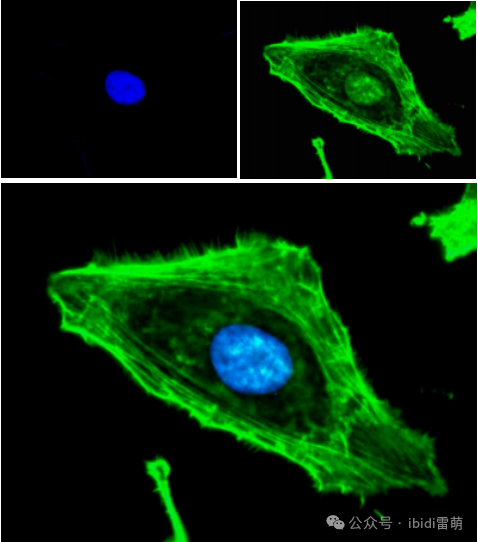
HT1080細胞在µ-Slide VI 0.4通道載玻片中的寬場熒光顯微成像。使用phalloidin(綠色)觀察F-actin細胞骨架。細胞核用DAPI(藍色)染色。使用Plan Neofluar 40x/0.75物鏡在蔡司Axiovert 135顯微鏡上進行成像。
您的熒光染色結果如果沒有您預期的那樣?請參閱 immunofluorescence troubleshooting guide
ICP備案號:
滬ICP備15057650號-1
 滬公網安備31011202005471
滬公網安備31011202005471
雷萌生物科技(上海)有限公司 保留所有版權.